1) Généralité 1A
Déf : maladie inflammatoire chronique du système nerveux central (SNC), caractérisée par l’atteinte de la gaine de myéline associée à une atteinte axonale primitive ou secondaire.
Physiopathologie
– Attaque de la gaine de myéline par le système immunitaire (clone lymphocytaire auto-réactif) : maladie auto-immune à médiation cellulaire
– Présence de plaque de démyélinisation focale disséminées dans la substance blanche du SNC (symptômes cliniques en lien avec la localisation de la plaque)
– Remyélinisation possible grâce aux oligodendrocytes (permet une récupération entre les poussées)
– Atteinte axonale primitive ou secondaire observée
Epidémiologie
– 100 000 patients en France (1 cas/1000 personnes)
– Gradient nord-sud (2 fois plus dans les pays scandinaves que méditerranéens) 1A, rare chez l’enfant (25-30 cas / an en France) 3
– Prédominance féminine : sex-ratio = 3
2) Diagnostic 1A
Il n’existe pas de test permettant le diagnostic de SEP ; celui-ci repose sur un faisceau d’arguments
| Clinique – Paraclinique |
|---|
| Dissémination spatiale et temporelle (critère de McDonald) Inflammation localisée au système nerveux Pas d’autre explication (dg différentiels éliminés) |
A ) Clinique
Les signes cliniques sont variables selon la localisation de la (des) plaque(s). Les symptômes sont très souvent d’installation subaigüe (quelques heures / jours) avec régression, plus rarement insidieux avec aggravation progressive (10-15%).
Pas d’atteinte en dehors du SNC !
-
Anamnèse
Terrain
– Adulte de 20 à 40 ans ++
– ATCD : personnels (épisode neuro antérieur) et familiaux 0
Facteurs de risque : la SEP est une maladie multi-factorielle, de nombreux facteurs restent inconnus.
Facteurs génétiques
– Population caucasoïde
– 30 % de concordance chez les jumeaux homozygotes VS 3% chez les hétérozygotes)
– Gènes de susceptibilité notamment certains allèles HLA
Facteurs environnementaux
– Infection à EBV
– Hygiène « excessive » durant l’enfant (moindre infection à certaines infections dans l’enfance 1les parasitoses infantiles auraient un effet protecteur.
– Tabagisme actif et passif
– Carence en vitD et/ou faible ensoleillement, surtout dans l’enfance
– Obésité
-
Examen physique
Atteintes motrices
– Troubles de la marche : limitation du périmètre, fauchage
– Troubles de l’équilibre (syndrome cérébelleux)
– Mono- ou paraparésie, voire hémiparésie (syndromes pyramidaux)
Atteintes sensitives
– Signe de Lhermitte : sensation de décharge électrique très brève le long de la colonne vertébrale à l’antéflexion de la tête (atteinte des cordons postérieurs de la moelle cervicale, très évocateur!)
– Autres : par- / hypo- / anesthésie, douleurs, décharges, sensations de chaud ou de froid…
Atteintes ophtalmo (inaugural dans 20% des cas) 1C
– Névrite optique rétrobulbaire
– Paralysie oculomotrice : paralysies du VI (diplopie, déficit d’abduction), ophtalmoplégie internucléaire antérieure, paralysie supra-nucléaire
– Nystagmus
– Périphlébite rétinienne (engainement blanchâtre des veines rétiniennes périphériques)
Autres : rare au début mais fréquent dans l’évolution
Atteintes du tronc cérébral
– Diplopie
– Ophtalmoplégie internucléaire antérieure
– Paralysie faciale centrale ou périphérique
– Névralgie faciale
– Dysarthrie
– Troubles de déglutition
– Troubles de conscience 3
Atteinte médullaire 3 : myélite aiguë transverse
Troubles sphinctériens
– Hyperactivité vésicale : impériosités, pollakiurie
– Hypertonie sphinctérienne : dysurie
Fatigue, troubles cognitifs…
B ) Paraclinique
-
IRM
Encéphalique (± médullaire si nécessaire aux critères diagnostiques)
Signal pathologique : lésions ovoïdes, souvent > 3mm. Grand axe perpendiculaire à l’axe des ventricules (pour les lésions péri-ventriculaires)
– Hypersignal T2 / FLAIR
– Hyposignal T1 (« trous noirs »)
– Les lésions récentes (<1mois) prennent le contraste en T1 injecté
Topographie : on distingue 4 zones
– Péri-ventriculaire (touche le ventricule)
– Juxta-corticale (touche le cortex)
– Sous-tentorielle (cervelet, tronc cérébral)
– Médullaire
Remarque : L’atteinte du corps calleux est très évocatrice 1B
Montre l’inflammation ++, et permet d’écarter certains diagnostics différentiels.
LCS inflammatoire
– Bandes oligoclonales en iso-électrofocalisation, ou à défaut en immunofixation (>90%)
– Et/ou index IgG augmenté > 0,7
Autres anomalies
– Elévation des gammaglobulines (70%), non-retrouvée dans le sang
– Hyperprotéinorachie modérée < 1 g/L (25%)
– Cellules mononuclées, généralement < 50 éléments / mm³
Parfois LCS normal
-
Autres examens pouvant contribuer au diagnostic
Potentiels évoqués (surtout visuels PEV en cas de névrite optique rétrobulaire). Disparus des critères diagnostiques, ils sont de moins en moins utilisés. Utile en cas d’IRM et PL non contributive, ils peuvent montrer des anomalies de conduction du nerf optique chez un patient asymptomatique 3.
Examen ophtalmologique 3
– Acuité visuelle, fond d’oeil (papillite / pâleur papillaire), champ visuel
– OCT : quantification de la perte axonale du nerf optique après une 1ère poussée de névrite optique
C ) Diagnostic différentiel
Importance de la clinique (atteinte extra-neurologique), de l’IRM et de l’étude du LCS
Autres pathologies intermittentes du SNC
– Affections inflammatoires du SNC limités : névrite optique auto-immune idiopathique, neuromyélite optique)
– maladies inflammatoires systémiques (sarcoïdose, Behçet, LES, Gougerot-Sjögren), artérites cérébrales, infections neuro-méningées (dont encéphalomyélite aiguë disséminée chez l’enfant 3), maladie cérébrovasculaire à attaques successives
Autres causes d’atteinte neurologique localisée : tumeur, malformation vasculaire, compression médullaire
D) Synthèse – Diagnostic 2
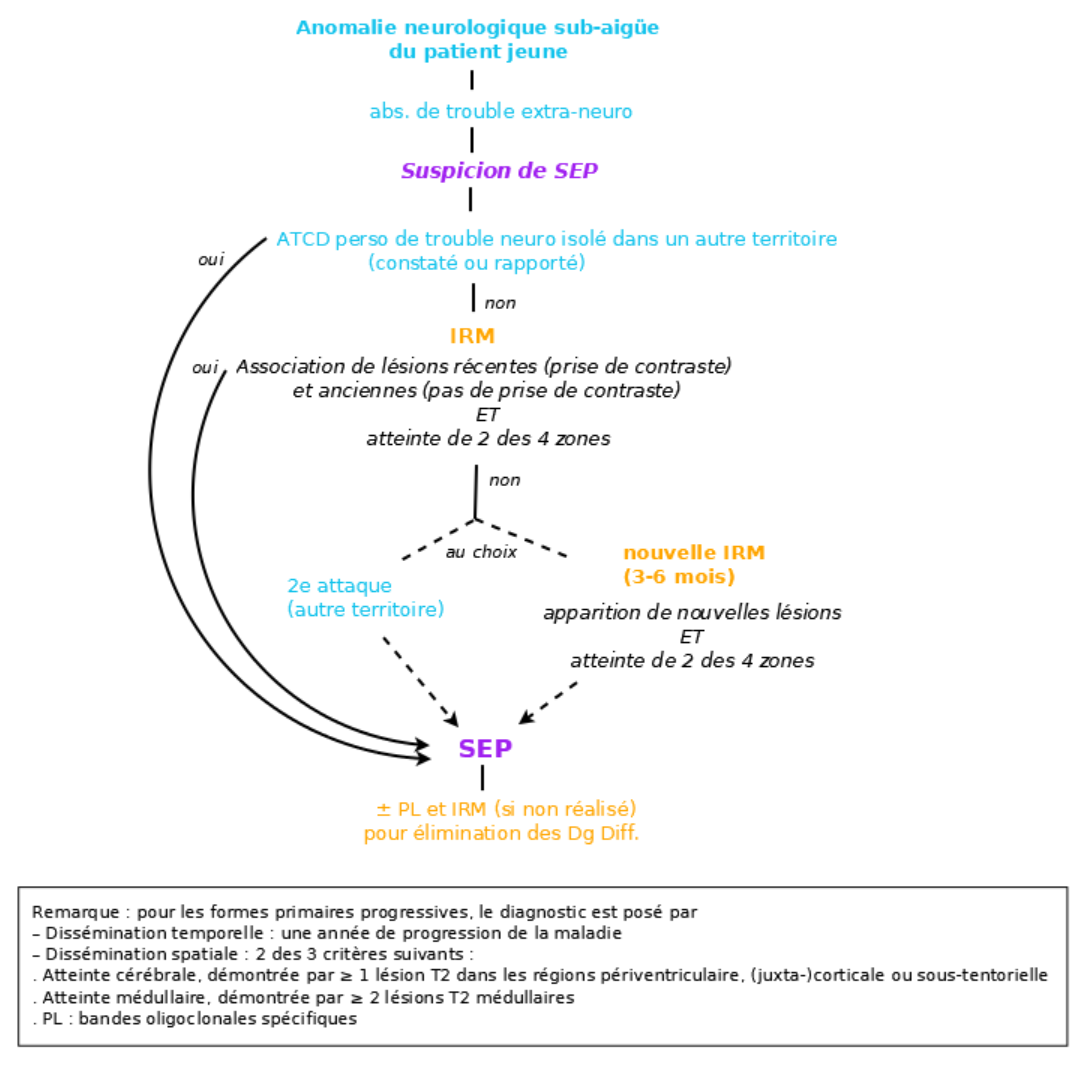
Les critères de McDonald 2017 sont utilisés pour le diagnostic. Il nécessite des critères cliniques ou paracliniques (IRM++) de disséminations temporelle ET spatiale.
L’élimination des diagnostics différentiels fait également partie intégrante du diagnostic 1A
Critère de dissémination temporelle (DIT) :
– Clinique : 2e attaque clinique
– IRM : Association de lésions récentes (prise de contraste) et anciennes (pas de prise de contraste) sur le même examen OU apparition de nouvelles lésions sur un 2e examen (souvent réalisé 3-6 mois après la première attaque, même en l’absence de nouveaux symptomes1A)
– PL : bandes oligoclonales spécifiques (ne prouve pas la dissémination temporelle mais peut se substituer à ce critère pour des patients avec critère de dissémination spatiale en l’absence de meilleure explication diagnostique)
Critère de dissémination spatiale (DIS) :
– Clinique : 2 signes (lors de la même attaque ou pas) ne pouvant être expliqués par 1 seule lésion
– IRM : atteinte de 2 des 4 zones (périventriculaire, corticale ou juxta-corticale, sous-tentorielle et médullaire). La distinction entre les lésions symptomatiques et asymptomatiques n’est plus nécessaire.
Remarque : pour les formes primaires progressives, le diagnostic est posé par
– Dissémination temporelle : une année de progression de la maladie
– Dissémination spatiale : 2 des 3 critères suivants :
• Atteinte cérébrale, démontrée par ≥ 1 lésion T2 dans les régions périventriculaire, corticale ou juxta-corticale, ou sous-tentorielle
• Atteinte médullaire, démontrée par ≥ 2 lésions T2 médullaires
• PL : bandes oligoclonales spécifiques
Note : le diagnostic peut être purement clinique si les critères de dissémination spatiale et temporelle sont remplis (2 attaques, 2 signes objectivables ne pouvant se rapporter au même territoire du SNC). Le diagnostic peut être retenu avec 1 seul signe objectivé si l’interrogatoire révèle un ATCD (« historical evidence ») d’attaque clinique caractéristique impliquant un territoire anatomique différent.
3) Evolution 1A
A) Histoire naturelle
-
2 évenements de base
Poussée
– Apparition / réapparition / aggravation des symptômes (à l’exclusion de l’asthénie et des signes en contexte fébrile)
– Installation subaiguë en quelques heures / jours, durée ≥ 24h, avec récupération ± complète
– 2 poussées sont (par définition) séparées d’au moins 1 mois
Progression
– Aggravation continue des symptômes neuro sur ≥ 1 an
-
3 présentations évolutives
Forme rémittente / récurrente (85-90 % initialement)
– Poussées exclusives, débutant en moyenne vers 30 ans
– ± Séquelles stables entre les poussées. Une séquelle est considérée comme irréversible lorsque le symptôme persiste > 6 mois 3.
Forme secondairement progressive : évolution naturelle après 15-20 ans de forme rémittente / récurrente
Forme primaire progressive (10-15 % initialement)
– Progression d’emblée sans poussée, débutant en moyenne vers 40 ans (sex-ratio = 1)
– Atteinte médullaire chronique et troubles génito-sphinctériens précoces
B) Pronostic
Le pronostic de la SEP est très hétérogène, et imprévisible pour un individu donné.
– L’espérance de vie est peu altérée
– Les troubles de la marche apparaissent après 8 ans d’évolution, un fauteuil roulant est nécessaire après 30 ans en moyenne.
– 25% des patients ont une évolution bénigne.
– 10% des patients sont atteint de formes graves avec grabatisation rapide.
Des facteurs de mauvais pronostic ont été identifiés :
– Age de début > 40 ans
– Forme primaire progressive
– Atteinte motrice initiale
– Autres 3 : sexe féminin, intervalle < 1 an entre les deux 1ères poussées, critères IRM de SEP sur l’imagerie initiale, absence de trouble de la vigilance lors du 1er épisode
Chez l’enfant, des facteurs de rechute après un 1er épisode démyélinisant ont été identifiés 3
– 1ère poussée après l’âge de 10 ans
– Radiologiques : lésions bien délimitées, perpendiculaires au grand axe du corps calleux ; lésions IRM du nerf optique ; hyposignal T1 ; ≥ 1 lésion péri-ventriculaire
– Un tableau initial de myélite ou l’existence de troubles de la vigilance sont associés à un moindre risque de récidive
4) PEC 1A
A ) Bilan
(Aucun bilan n’est détaillé dans le CEN…)
Si la clinique ne fournit pas le critère de dissémination temporelle, on répète habituellement l’IRM cérébrale à 3-6 mois du bilan initial.
L’IRM médullaire est demandée s’il existe des signes évocateurs de cette localisation, ou pour chercher à satisfaire le critère de dissémination spatiale.
Le score EDSS 3 (Expanded Disability Status Scale) est à évaluer à chaque consultation. C’est un score clinique évaluant différentes fonctions centrales, coté de 0 à 10
– Un score à 4 indique une limitation de la marche modérée (possibilité de marcher 500m sans repos et sans aide)
– Un score à 6 indique une possibilité de marche de 100m avec support unilatéral
– Un score à 7 indique une possibilité de marche de 5m avec un support
B ) Traitement
-
Mesures générales
ALD 100% 0
PEC multidisciplinaire : généraliste, neurologue, kiné, rééducation fonctionnelle, psychologue, ergothérapeute…
Mesures préventives 3 : supplémentation en vitamine D, vaccinations
-
Traitement de la poussée : corticoïdes
Méthylprednisolone 1g / j en perfusion de 3h IV sur 3 jours
– Non systématique, ssi symptômes gênants
– Accélère la récupération de la poussée, mais ne prévient pas les suivantes
– Seule la 1ère perfusion est obligatoirement réalisée en milieu hospitalier
Immunoglobulines 3 : amélioration des situations de NORB et ADEM résistant aux corticoïdes chez l’enfant. Pas d’efficacité supérieure chez l’adulte.
Plasmaphérèses dans les poussées sévères avec réponse insuffisance aux corticoïdes et immunoglobulines 3
-
Traitements de fond
Ces traitements, souvent coûteux (700 à 1800€ / mois), réduisent la fréquence des poussées (-30 % pour les IFN-β, -50% pour le fingolimod, -70 % pour le natalizumab) et la progression du handicap à court terme.
Aucun de ces traitements n’a démontré son efficacité dans les formes primitivement progressives.
| Molécule | Voie | Effets indésirables | Surveillance |
|---|---|---|---|
| Immunomodulateurs | |||
| IFN-β | SC ou IM | Sd pseudo-grippal les 1ères semaines (50%) | NFS et transaminases / 3 mois |
| Acétate de glatiramère | SC | – | |
| Diméthyl-fumarate et tériflunomide | PO | Troubles digestifs Bouffées congestives pour le diméthyl-fumarate |
NFS et transaminases |
| Immunosuppresseurs : ssi forme sévère ! | |||
| Mitoxantrone | IV / mois | Toxicité cardiaque Leucémie myéloïde aiguë (1%) |
Surv. cardiaque NFS |
| Natalizumab | IV / mois | LEMP à JC virus (3/1000 après 2 ans de ttt) | |
| Fingolimod | PO | Tbl de conduction cardiaque Oedème maculaire Infections |
|
Note 3 : le PNDS distingue les traitements de 1ère ligne (IFN-β et acétate de glatiramère) et de 2e ligne (natalizumab, hors AMM avant 18 ans, autres en cours d’évaluation).
Enfin, d’autres immunosuppresseurs sont parfois utilisés (hors AMM) : azathioprine, rituximab, cyclophosphamide, mycophénolate mofétil
-
Traitements symptomatiques
Spasticité : ssi néfaste pour le patient
– Baclofène faible dose (risque d’aggravation par hypotonie)
– Formes sévères : injection locale de toxine botulique, implantation d’une pompe intrarachidienne de baclofène
– Kinésithérapie contre l’hypertonie et les déformations
Troubles urinaires
– Hyperactivité vésicale : anticholinergiques
– Résidus post-mictionnels : autosondages intermittents pluriquotidiens, ± injections intra-vésicales de toxine botulique
– Importance de la PEC des infections urinaires (risque d’aggravation de la spasticité)
Autres
– Troubles sexuels : PEC médicamenteuse, consultation sexologue
– Suivi psychologique, psychothérapies, PEC d’un syndrome dépressif
– Douleurs : antalgiques classiques, tricycliques, certains anti-épileptiques
– Fatigue : activité physique (pas de médicament avec AMM)





8 réponses à “Sclérose en Plaques”
Nous avons écrit : Les lésions au niveau du tronc cérébral ou médullaire responsables de signes cliniques ne doivent pas être comptabilisées.
Cette phrase est une interprétation de la source 2, en anglais : DIS can be demonstrated with at least 1 T2 lesion in at least 2 of 4 locations considered characteristic for MS and as specified in the original McDonald Criteria (juxtacortical, periventricular, infratentorial, and spinal cord), with lesions within the symptomatic region excluded in patients with brainstem or spinal cord syndromes.
2 commentaires par rapport à cela :
– les lésions du TC sont dans les lésions infratentorielle ou médullaire ? Si infratentorielle, il faut donc différentier les lésions du TC avec d’autres lésions infratentorielle (cervellet) ?
– Supposons un patient avec une hémiparesie. En IRM, on trouve une lésion cérébrale + une lésion du TC, d’age différent. On peut donc poser le dg. Pour un autre patient avec le même tableau clinique et IRM + une expression clinique de la lésion du TC : on ne doit alors pas compté la lésion du TC, et donc le dg n’est pas possible alors qu’il a encore plus de signes que le premier patient… ?! Bizare bizare…
Quand débute-t-on le traitement ?
– pour le traitement des poussées, une corticothérapie est-elle possible dès la première crise (avant le diagnostic formel) en cas de forte suspicion ?
– à partir de quand débute-t-on le traitement de fond ? Dès le dg posé ? En particulier pour les formes progressives, pour lesquelles le dg formel n’est posé au plus tot qu’au bout d’1 an.
Eléments de réponse dans le PNDS (concernant l’enfant) :
=> Pas de réponse explicite concernant la 1ère attaque sans validation des critères diagnostiques, mais si la présentation initiale est une encéphalomyélite aiguë disséminée, le traitement sera de toute manière une corticothérapie.
=> « La mise en place précoce d’un traitement de fond est recommandée dès la validation du diagnostic de SEP. »
Voir aussi le site de l’arsep pour des info patients : https://www.arsep.org/fr/159-la-sep.html
Réalise-t-on systématiquement une IRM ? D’après les critères de McDonald, le diagnostic peut être clinique (critère spatio-temporel). Une IRM est-elle alors indispensable, notamment pour l’élimination de dg différentiels ?
Même question pour la ponction lombaire : la réalise-t-on systématiquement pour l’élimination des dg diff ?
Petite question : le corps calleux fait partie de quel groupe ? juxta-cortical ou periventriculaire ?
Il est intéressant de voir que la définition parle d’atteinte du système nerveux central, mais qu’il existe des atteintes de nerfs périphériques (nottament une paralysie faciale périphérique). Pourquoi ?!
Mise à jour Mars 2019 : les critères de McDonald 2017 éclaircissent plusieurs points
– La notion de lésions symptomatiques / asymptomatiques a disparu des critères.
– Le diagnostic précoce est facilité (diagnostic possible avec 1 attaque objectivée et 1 ATCD d’attaque)
A noter également : les lésions IRM corticales doivent désormais être prises en compte, dans le même groupe que les lésions juxta-corticales.