1) Généralité 1C
-
Définition
Zoonose cosmopolite due à un parasite protozoaire, Toxoplasma gondii
-
Physiopathologie
– Envahissement active de tous les organes par les tachyzoïtes hébergés dans les cellules mononuclées : Phase de parasitémie de durée variable (2-3 semaines, voire plusieurs mois)
– Réponse immunitaire type cellulaire T efficace ⇒ contrôle de la multiplication parasitaire et enkystement du parasite
– Les kystes persistent toute la vie de l’hôte (cellule musculaires, cellule nerveuses et cellules rétiniennes +++)
– Persistance des kystes ⇒ certaine immunité (empêche toute nouvelle infection par un toxoplasme de même type génétique)
– En cas de déficit immunitaire cellulaire : re-transformation des bradyzoïtes contenus dans les kystes en tachyzoïtes qui sont libérés
– Tachyzoïtes libérés ⇒ destruction locale avec lésions inflammatoires et nécrose ; dissémination hématogène à d’autres organes
-
Epidémiologie
– 600000-700000 nouvelles infections chaque année en France (dont 2500-4000 chez des femmes enceintes) 1C
– parmi les 46 % de femmes enceintes séronégatives, 2 % font une séroconversion gravidique, aboutissant à 1500-2000 formes congénitales par an 1B
Agent pathogène Bradyzoïte Sporozoïte Cycle parasitaire
A ) Clinique Toxoplasmose du sujet immunocompétent (primo-infection) Toxoplasmose du sujet immunodéprimé 1C (primo-infection ou réactivation d’ancien kystes cérébraux ou oculaires) Toxoplasmose intraplacentaire ou congénitale 1B Biologie à la phase aiguë 1A (aspécifique) : syndrome mononucléosique et hyperéosinophilie modérés, cytolyse hépatique Sérologie (voir interprétation) PCR (dg de certitude) : sur humeur aqueuse, LCS, Biopsie cérébrale, Liquide amniotique (2% de faux négatifs 1B) Cas particulier du sujet immunodéprimé Cas de la toxoplasmose congénitale Interprétation des sérologies toxoplasmiques Chez sujet immunodéprimé : autres causes d’abcès cérébral – La primo infection évolue favorablement sans traitement chez l’immunocompétent. TDM ou IRM cérébrale injectée en urgence si suspicion de forme cérébrale 0 Bilan d’une séroconversion gravidique 1B Chez l’immunocompétent : pas d’indication de traitement de la primo-infection (ttt symptomatique simple) sauf si asthénie intense 1C (Rovamycine 1,5 MUI/ 10 kg/jour chez l’enfant, 6-9 MUI /jour pendant 1 mois chez l’adulte) et chez la femme enceinte (spiramycine 1ère intention) Chez l’immunodéprimé 1C Prévention primaire 0 Prévention secondaire chez l’immunodéprimé : idem forme cérébrale à demi dose tant que les lymphocytes CD4 sont < 200 / mm3 (risque de réactivation) PEC d’une séroconversion gravidique 1B : selon le bilan
– Transmission directe par ingestion d’aliments contaminés par les oocytes contenus dans les excréments de chat (hôte définitif)
– Consommation de viande de bœuf ou de porc crue ou mal cuite contenant des kystes
– Transmission transplacentaire 1B : risque de transmission croissant avec le terme (de 1 % avant 7SA à > 50 % au T3), mais gravité décroissante avec l’âge gestationnel au moment de la transmission (embryo-fœtopathie au T1, formes séro pures ou choriorétinite au T3) 1La transmission transplacentaire est due aux tachyzoïtes 1C .
Parasitologie
Toxoplasma gondii, 3 formes évolutives
Tachyzoïte
– Stade intracellulaire
– Taille : 6-8 μm de long sur 3-4 µm
– Parasite n’importe quelle cellule nuclée de l’organisme (cellules mononuclées du système des phagocytes) et s’y multiplie rapidement
– Morphologie très proche des tachyzoïtes
– Métabolisme lent conduisant à un état de latence (peu ou pas de multiplication)
– Ils sont regroupés (quelques dizaines à plusieurs milliers dans les kystes intracellulaires (y sont inaccessibles aux défenses immunitaires et aux traitements actuels)
– Taille des kystes : 20-100 μm
– Sièges principaux des kystes : neurones, astrocytes, cellules musculaires, cellules rétiniennes
– Contenu dans des oocystes pouvant survivre sur le sol plus d’un an (climat humide)
– Oocystes : forme ovoïde, environ 12 μm
– Cycle complet : phase de reproduction sexuée chez les hôtes définitifs (chat et félidés sauvages) et une phase de reproduction asexuée (Hôte intermédiaire : autres animaux homéothermes)
– Cycle incomplet (uniquement entre hôte intermédiaire ; phases de reproduction asexuée)2) Diagnostic 1A
Clinique
Paraclinique
Asymptomatique +++ (primo-infection)
Asthénie, Fièvre modérée, PolyadénopathiesSérologie
PCR
– Souvent asymptomatique (80%-90% des cas)
– Asthénie, fièvre modérée, polya-dénopathies (cervicale et occipitale), céphalées, arthro-myalgies, éruption maculo-papuleuses
– Choriorétinite (5 à 10 %)
– Tableau d’abcès cérébraux avec signes de focalisations neurologiques, fièvre inconstante (Tableau d’encéphalite diffuse parfois)
– Choriorétinite
– Pneumopathie interstitielle diffuse fébrile dyspnéisante
– Toxoplasmose disséminée (fièvre isolée ++)
– Forme infraclinique (70 % des contaminations in utero)
– Forme légère (choriorétinite, 25 %)
– Forme grave 1C (rare, tableau d’encéphalo-méningo-myélite, choriorétinite pigmentaire, microphtalmie, tableau d’infection néonatale grave, pronostic péjoratif)B ) Paraclinique 1C
– Apparition des IgM puis des IgG (les IgG persistent toute la vie à un taux résiduel, les IgM se négativent après 7-12 mois)
– Pendant la grossesse, dépistage systématique par sérologie au T1 (sauf immunité documentée antérieurement), répétée mensuellement chez les femmes non-immunisées 1B.
– Patient réactivant une toxoplasmose ancienne : la sérologie permet uniquement d’orienter le diagnostic ; détection du parasite
– Patient atteint d’une primo-infection : sérologie contributive ; retard d’apparition des anticorps possible
– En anténatal : amniocenthèse pour PCR sur liquide amniotique
– A l’accouchement : détection d’anticorps synthétisés par l’enfant (sang du cordon, sang J3-J10) ; détection du parasite par PCR (placenta, sang du cordon ou LA pernatal) 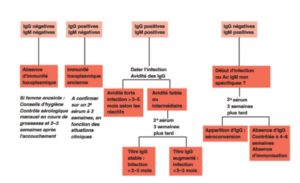
C ) Diagnostic différentiel 0
3) Evolution 1A
– L’infection congéniale est grave (surtout lorsqu’elle survient tôt)4) PEC 1A
A ) Bilan initial
– Suivi écho mensuel (recherche de signes foetaux d’infection neuro : hydrocéphalie, calcifications…)
– Amniocentèse pour recherche de toxoplasme par PCR dans le LA, après 18 SA et ≥ 6 semaines après la séroconversionB ) Traitement
– En 1ère intention : Pyriméthamine (50-75 mg/jour après dose de charge de 100 mg le 1er jour) + acide folinique (25mg/jour) + sulfadiazine (100-150 mg/kg/jour soit 4-6 g/jour) pendant 3-6 semaines (traitement d’attaque) puis traitement d’entretien (demi-dose des mêmes molécules)
– En 2e intention : Pyriméthamine (50 mg/jour) + clindamycine (2,4g/jour)
– En 3e intention : Atovaquone (pas d’AMM) 750 mg x 4/jour C ) Prévention
– Eviter le contact avec les excréments de chat
– Consommer des aliments bien lavés
– Bien cuire la viande avant consommation
– Echo et PCR négatives : spiramycine 1ère intention jusqu’à la fin de grossesse (réduit le risque de transmission materno-foetale)
– Echo normale et PCR positive (fœtus infecté) : sulfadiazine (réduit la fréquence des atteintes cérébrales, pas les choriorétinites) + acide folinique, surveillance écho rapprochée tous les 15 jours
– Echo anormale et PCR positive (fœtus symptomatique) : discuter IMG, sinon PEC comme une infection foetale asymptomatique
– Suivi de l’enfant : clinique et sérologique (disparition des Ig maternelles après 4-6 mois), fond d’oeil, écho transfontanellaire





Une réponse à “Toxoplasmose”
A noter que le dépistage de la toxoplasmose congénitale n’existe pas (plus) en allemagne ou en suisse.
« En Suisse, la baisse de la séroprévalence de 53 à 20 % chez la femme enceinte entre 1982 et 2015 a été accompagnée par celle de l’incidence des infections congénitales de 85 %, passant de 0,08 à 0,012 %.2 Sur 34 ans de surveillance, seuls 39 cas de toxoplasmose congénitale ont été diagnostiqués, dont seulement 4 présentaient des symptômes à la naissance et 2 autres des symptômes pendant le suivi »
https://www.revmed.ch/RMS/2020/RMS-N-682/Toxoplasmose-et-cytomegalovirus-congenitaux-en-Suisse-en-2019